第一章
リン酸
リンは、動植物体の生活と深く関係しており、
12世紀には尿と粘土、石灰および炭からリンらしいものを得ている。
その性質はみずから輝くという不思議な性質を持っていた。
17世紀 Brand により暗所で光る物質の製法を発見した。
その後、18世紀にはリン酸の製造方法が確立されていくことになる。
尿だけでなく骨にリンが含まれていることも発見した。
リンの英語表記は「Phosphorous」であり
ギリシャ語の(light)と(I bear)から来ており、
自ら光を発するものという意味である。
リン酸とは
リン酸(別名オルトリン酸)とは、P(リン原子)が酸化され安定な状態である5価の酸化物であり、H3PO4 として示される。構造は、正四面体の中心にリン原子、各頂点に酸素原子を配置し、全体で3-(マイナス)の電荷を有する。
一般的には85%もしくは75%リン酸水溶液として市販されている。
特徴的な性質は、三塩基性酸であるため水溶液中でpHにより存在するイオン形が異なり、そのためpH緩衝作用を有する。このことは、金属緩衝作用にも通じるものがあり、食品添加物分野、工業分野などで広く用いられる要因である。
pH緩衝作用とは、リン酸が水溶液中での解離によって引き起こされる。リン酸水溶液に対して水酸化ナトリウム溶液で中和滴定した場合のpH変化を図1に示す。
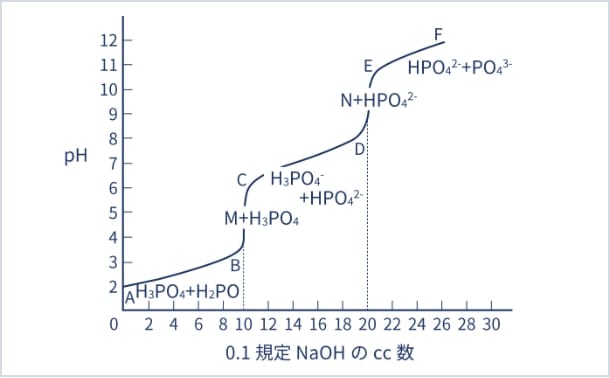
【図1】リン酸(0.1mol/L)のpH曲線
最初は、pH1~2を示し、ここに水酸化ナトリウム溶液を添加すると、一部中和されて
H3PO4 + NaOH →
NaH2PO4 + H2O・・・(1)
の反応が起こる。第一変曲点まではpHが大きく変動することなく3~4の値を示す。
さらに水酸化ナトリウム溶液を添加し続けると、pHが3から6へ急変する。この部分は第一変曲点と言われ、pH緩衝作用は弱い。(1)式の中和が行われ、溶液中にはNaH2PO4のみが存在することになる。
さらに水酸化ナトリウム溶液を添加すると
NaH2PO4 + NaOH →
Na2HPO4 + H2O・・・(2)
の反応が起こり再びpH緩衝作用を示す。これは第二変曲点まで続く。
さらに水酸化ナトリウム溶液を添加すると
Na2HPO4 + NaOH →
Na3PO4 + H2O・・・(3)
の反応が進みpH11以上でもpH緩衝作用を示す。
これらは、リン酸の電離が三段階になっており
K1=7.0~7.5×10-3
K2=8.0×10-8
K3=4.8×10-13
オルトリン酸の性質となっている。(また、縮合リン酸塩についても同様な性質を示すものもある。)